TERMOKIMIA
A.
PENGERTIAN TERMOKIMIA
Termokimia merupakan ilmu kimia
yang mempelajari perubahan kalor atau panas suatu zat yang menyertai suatu
reaksi atau proses kimia dan fisika.
Termokimia ini mempelajari
hubungan antara energi panas dan energi kimia. Energi kimia merupakan energi
yang dikandung setiap unsur atau senyawa, energi kimia yang terkandung dalam
suatu zat adalah semacam energi potensial zat tersebut. Energi potensial kimia
yang trkandung dalam suatu zat disebut panas dalam atau entalpi dan dinyatakan dengan simbol H. Selisih antara entalpi reaktan dan entalpi hasil pada suatu
reaksi disebut perubahan entalpi reaksi, dan diberi simbol ΔH.
 |
| TERMOKIMIA |
B.
BAHAN KAJIAN TERMOKIMIA
Bahan kajian termokimia adalah
penerapan hukum kekekalan energi dan hukum termodinamika I dalam bidang kimia.
Hukum kekekalan energi berbunyi :
1. Energi tidak dapat diciptakan
dan tidak dapat dimusnahkan.
2. Energi dapat berubah bentuk
menjadi energi lain.
Hukum termodinamika I berbunyi :
“Jumlah total energi dalam alam
semesta konstan atau tetap”
C.
SISTEM DAN LINGKUNGAN TERMOKIMIA
Segala sesuatu yang menjadi pusat
perhatian dalam mempelajari perubahan energi dan berubah selama proses itu
berlangsung disebut dengan sistem
Sedangkan hal-hal yang tidak
berubah selama proses berlangsung dan yang membatasi sistem dan juga dapat
mempengaruhi sistem disebut lingkungan
Berdasarkan interaksinya dengan
lingkungan, sistem diagi menjadi tiga macam, yaitu
1.
Sistem Terbuka
Sistem terbuka adalah suatu sistem
yang memungkinkan terjadi perpindahan energi dan zat (materi) antara lingkungan
dengan sistem. Pertukaran materi artinya ada reaksi yang dapat meninggalkan
wadah reaksi, misalnya gas
2.
Sistem tertutup
Suatu sistem yang mana antara
sistem dan lingkungan dapat terjadi perpindahan energi, tapi tidak terjadi
pertukaran materi
3.
Sistem terisolasi
Suatu sistem yang memungkinkan
terjadinya perpindahan energi dan materi antara sistem dengan lingkungan
D.
REAKSI TERMOKIMIA
Reaksi pada termokimia terbagi
atas reaksi eksoterm dan reaksi endoterm.
1.
Reaksi Eksoterm
Reaksi yang terjadi saat
berlangsungnya pelepasan panas atau kalor. Reaksi panas ditulis dengan tanda
negatif.
Contoh : N2 (g) + 3H2 (g) 2NH3 (g)
- 26,78 Kkal
Perubahan entalpi pada reaksi ini
digambarkan sebagai berikut:
Menurut hukum kekekalan energi :
2.
Reaksi Endoterm
Reaksi yang terjadi ketika
berlangsungnya penyerapan panas atau kalor, maka perubahan entalpi reaksi
bernilai positif.
Contoh : 2NH3 N2 (g) + 3H2 (g) +
26,78 Kkal
Perubahan entalpi pada reaksi
endoterm dirumuskan sebagai berikut:
Kesimpulan :
Besarnya perubahan entalpi (ΔH)
sama dengan besarnya panas reaksi, tapi dengan tanda berlawanan.
E.
JENIS PERUBAHAN ENTALPI
1.
Perubahan entalpi pembentukan (ΔHf)
Merupakan perubahan entalpi
pembentukan 1 mol senyawa dari unsur-unsur penyusunnya pada keadaan standar.
Nilai entalpi pembentukan standar
ditentukan menggunakan tabel data entalpi pembentukan standar.
Nilai entalpi pembentukan standar:
- Bernilai positif, jika menerima
energi
- Bernilai negatif, jika melepas
energi
- Bernilai nol, jika unsur tersebut
sudah terdapat di alam secara alami
- Bentuk unsur yang sdah di alam
terbagi atas monoatomik dan poliatomik. Poliatomik berarti unsur pembentuknya
lebih dari 1 unsur.
- Contoh monoatomik : C(s), Fe(s),
H+(aq), Ba(s), Ca(s), Mg(s), Na(s), Al(s), B(s), Zn(s), P(s). Monoatomik
termasuk golonga gas mulia dan logam lainnya.
- Contoh poliatomik : O2(g), Cl2(g),
P4(s), H2(g), Br2(l), N2(g), I2(g), F2(g). Poliatomiktermasuk halogaen dan gas
selain gas mulia.
Semua unsur-unsur yang sudah
terdapat dialam ini nilai entalpi pembentukannya nol.
Misal:
2.
Perubahan entalpi penguraian (ΔHd)
Adalah ΔH untuk menguraikan 1 mol
suatu senyawa menjadi unsur-unsur penyusunnya pada keadaan standar.
Nilai entalpi penguraian standar berlawanan
dengan nilai entalpi pembentukan standar. Pada reaksi penguraian reaktan
berpindah ke kanan dan produk berpindah ke kiri.
 |
| PERUBAHAN ENTALPI PENGURAIAN |
3.
Perubahan entalpi pembakaran (ΔHc)
Adalah ΔH dalam pembakaran
sempurna 1 mol suatu senyawa pada keadaan standar.
Nilai entalpi pembakaran standar
ditentukan menggunakan tabel data entalpi pembakaran standar
Ciri utama dari reaksi pembakaran
adalah:
- Merupakan reaksi eksoterm
- Melibatkan oksigen dalam reaksinya
- Karbon terbakan menjadi CO2,
hidrogen terbakar menjadi H2O, dan belerang terbakar menjadi SO2.
 |
| PERUBAHAN ENTALPI PEMBAKARAN |
4.
Perubahan entalpi netralisasi (ΔHn)
Termasuk reaksi eksoterm. Adalah
kalor yang dilepas pada pembentukan 1 mol air dan reaksi asam-basa pada suhu 25
derjat celsius dan tekanan 1 atmosfer.
 |
| PERUBAHAN ENTALPI NETRALISASI |
F.
PENENTUAN ENTALPI REAKSI
Penentuan ini dilakukan dengan:
- Menggunakan kalorimetri
- Menggunakan hukum Hess atau hukum
penjumlahan
- Menggunakan data tabel entalpi
pembentukan
- 4Menggunakan data energi ikatan
1.
Penentuan dengan kalorimetri
Kalorimetri
adalah cara penentuan energi kalor reaksi dengan kalorimeter. Kalorimeter
adalah sistem terisolasi, sehingga semua energi yang dibutuhkan atau dibebaskan
tetap berada dalam kalorimeter. Dengan mengukur perubahan suhu, kita dapat
menentukan jumlah energi kalor reaksi berdasarkan rumus:
Ql =
energi kalor pada larutan (J)
m =
massa zat (kg)
c =
kalor jenis zat (J/kg°C)
C =
kapasitas kalor (J/°C)
Δt =
perubahan suhu (°C)
Karena kalorimeter merupakan
sistem terisolasi, maka tidak ada energi yang terbuang ke lingkungan, sehingga
mlah energi kalor reaksi dan perubahan entalpi reaksi menjadi:
2.
Penentuan dengan data energi ikatan
Energi
ikatan (E) adalah energi yang dibutuhkan untuk
memutuskan 1 mol ikatan kovalen dari suatu senyawa, setiap ikatan membutuhkan
energi yang berbeda agar dapat terputus.
Reaksi berlangsung dalam dua
tahap:
1) Pemutusan ikatan reaktan
2) Pembentukan ikatan produk
Tentukan perubahan entalpi reaksi
dari pembakaran CH2 dibawah ini:
CH2(g) + 3 /2O2(g) → CO2(g) +
H2O(g) ΔH = ?
(H–C–H)+ 3 /2(O=O)→(O=C=O)+(H–O–H)
G.
HUKUM TERKAIT TERMOKIMIA
1.
Hukum Laplace
Hukum ini dikemukakan oleh Marquis de Laplace (1749-1827), yang
berbunyi :
“Jumlah kalor yang dilepaskan pada
pembentukan suatu senyawa dari unsur-unsurnya sama dengan jumlah kalor yang
diperlukan untuk menguraikan senyawa itu menjadi unsur-unsurnya”.
Contoh :
H2(g) + ½ O2(g) à H2O(l) ΔH = -68,3 kkal/mol
H2O(l) à H2(g) + ½
O2(g) ΔH = 68,3 kkal/mol
2.
Hukum Hess
Hukum ini dikemukakan oleh German Hess (1840), yang berbunyi :
“Bila suatu perubahan kimia dapat
dibuat menjadi beberapa jalan/cara yang berbeda, jumlah perubahan energi panas
keselurahannya (total) adalah tetap, tidak bergantung pada jalan/cara yang
ditempuh”.
Menurut hukum Hess, suatu reaksi
dapat terjadi melalui beberapa tahap reaksi, dan bagaimanapun tahap atau jalan yang
ditempuh tidak akan mempengaruhi entalpi reaksi. Perubahan entalpi reaksi hanya
tergantung pada keadaan awal dan akhir sistem. Bukan tahap atau jalan yang
ditempuh. Perubahan entalpi ini juga merupakan penjumlahan entalpi reaksi dari
setiap tahap.
Dengan demikian hukum Hess dapat
digunakan untuk menghitung ΔH reaksi berdasarkan reaksi-reaksi lain yang ΔH-nya
sudah diketahui.
source: http://www.softilmu.com/2015/11/Pengertian-Kajian-Perubahan-Entalpi-Reaksi-Hukum-Termokimia-Adalah.html

















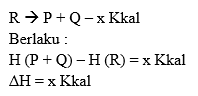












0 komentar: